주기율표로부터 알수있는 재료 정보
주기율표의 기원
원소 주기율표를 정리하려고 노력하려고 알려진 첫 번째 과학자는 프랑스의 화학자 라부아지에이다. 라부아지에는 당시까지 알려진 33개 원소를 4개 그룹으로 나누었다. 이것을 시작으로 물리, 화학적 유사성에 근거한 원소 분류가 시작되었다.
화학자 되베라이너는 세쌍 원소설을 제안하였고, 이후 뉼렌즈라는 화학자는 이 세쌍 원소설을 근거로 하여, 원소를 원자량 순서대로 나열해보면 여덟 번째마다 성질이 비슷한 원자가 나타난다는 옥타브설을 주장하였다.
마침내 1869년, 멘델레예프에 의해 그 당시까지 발견된 63종의 원소를 원자량 순서로 나열하였다. 그 결과, 성질이 비슷한 원소가 주기적으로 나타나는 것을 알 수가 있었다.
멘델레이프(Mendeleev, 1869.러시아)의 주기율 -원소 - 원자량의 순으로 배열 (63종)
-비슷한 성질의 원소가 주기적으로 등장
-미 발견 원소 예측.
원소의 물리 화학적 성질 - 원자량의 주기적 함수관계라는 원리 발견함 모즐리(Mosely, 1913. 영국)의 주기율
-원자량의 순서와 원소의 성질이 일치하지 않는 곳 발견
(예) Ar(39.95) 와 K(39.10),
Co(58.93) 와 Ni(58.70)
Te(127.6) 와 I (126.9)
주기율표 배치원리
원자가(최외각 전자수) 별로 나열해서 화학적 성질을 쉽게 알아보게 되어 있다. 가로로는 원자량 순으로 세로로는 원자가 순으로 배치되어 있다.
유효핵전하
-족: 아래로 갈수록 원자가껍질의 주양자수 증가, 유효핵전하 거의 일정 -주기: 오른쪽으로 갈수록 원자가껍질의 주양자수 일정, 유효핵전하 증가 유효 핵전하보다 전자껍질의 수가 원자의 주기적 성질에 더 큰 영향을 미치기 때문에.
주양자수와 주기의 관계
주족원소(s, p) : 주양자수 = 주기
전이원소(d) : 주양자수 = 주기 - 1
내부전이원소(f) : 주양자수 = 주기 - 2
18족 원소특징
비활성기체로서 모두 다 비금속원소이다. 그래서 다른 원소들과 잘 반응하지 않는다.
상온에서 모두 기체상태로 존재하고 전류가 흐르면 독특한 색을 띄어서 광고용 간판, 네온사인에 이용된다.
17족 원소특징
흔히 할로젠원소로 불린다.
상온에서 독특한 색을 내고 독성이 있으며 모두다 비금속원소라 열 과 전기 전도성이 낮다.
알칼리 금속과 반응하면 고체물질을 생산한다.
확장 주기율표 (Extended periodic table) 현재까지 주기율표는 7주기 18족까지만 있다. 그러나 원자번호 119번을 합성하는 순간 8 주기라는 새로운 주기가 시작된다. 과학자들의 예상으로는 이 8주기는 이전 주기와 다른 화학적 특징을 가지고 있을 가능성이 있어 장주기형 주기율표에 새로운 변화가 불가피하다. 이것을 확장 주기율표 (Extended periodic table) 이라 말한다.
주족원소
-껍질: 주양자수 : 주기수
-부껍질: 부양자수 : s와 p궤도함수만 사용
전이원소와 내부전이원소
주기내에서의 크기변화가 주족원소보다 적다
전자가 채워지는 동안 바깥껍질의 전자배치는 변함이 없기 때문 Sc(21번) - Zn(30번) : 4s 부껍질은 이미 채워져 있고 3d 부껍질이 채워짐 따라서 3d 전자에 의한 가리움 효과가 더 크기 때문에 더 서서히 감소 이온화에너지의 주기적 경향
족 : 위로 갈수록, 주기 : 오른쪽으로 갈수록 이온화에너지 증가 주기에서 약간 불규칙 (ⅢA족 B, ⅥA족 O)
주족원소의 전자친화도
이온화에너지와 비슷한 주기적 경향성을 보여 준다.
족: 위로 올라갈수록 커진다.
주기: 오른쪽으로 갈수록 전자친화도가 더 커진다.
=불규칙성도 나타난다.
-ⅡA족은 흡열, → 전자가 높은 p 궤도함수에 채워져야 하므로 ② 비금속원소인 경우 2주기 < 3주기
=작은 원자에 전자가 첨가됨으로 말미암아 반발이 증가하므로 족의 명명
1~2족, 12~18족에 있는 원소들은 전형 원소라고 한다.
3~11족에 있는 원소들은 전이 원소라고 하고 전형 원소와 다른 특징이 있다.
1족 : 알칼리금속족
2족 : 알칼리토금속족
13족 : 알루미늄족
14족 : 탄소족
15족 : 질소족
16족 : 산소족
17족 : 할로겐족
18족 : 비활성기체족
주기율표의 원소분류
주기율표에서 원소들은 크게 두 가지로 나뉘는데, 하나는 주족원소이고 다른 하나는 전이금속입니다. 주족원소는 1, 2, 13, 14, 15, 16, 17, 18족 원소들을 가리키는 말이고 전이금속은 3족에서 12족 사이, 4주기에서 6주기 사이의 금속원소들을 가리키는 말이다.
주기적 성질
-물리적 화학적 성질이 주기적으로 변함
-물리적 성질 : m.p, b.p, g원자부피, 융해열등
-화학적 성질 ; 금속성 및 비금속성, 이온화에너지 ,전기음성도. 전자 친화력 등
-원소를 원자번호 순서로 배열
-2, 8, 8, 18, 18, 32의 간격으로 비슷한 원소 등장 주기적 성질을 갖는 이유
-전자 배치의 규칙성 때문.
-성질이 비슷한 원소가 주기적으로 나타나는 이유
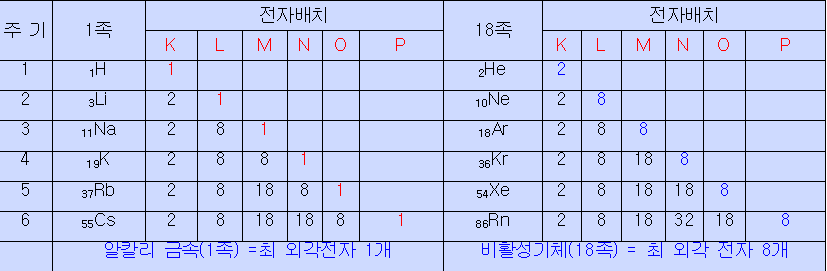
최외각 전자가 같은 원소가 주기적으로 등장하기 때문.
-원소의 주기성 : 최외각 전자 (원자가 전자) 때문
원자가전자 = 최외각전자 -> 원소의 화학성질을 결정
원자가 껍질 전자배치
원자가 껍질(valence shell)
전자가 채워진 껍질 중 n값이 가장 큰 껍질 =가장 바깥에 있는 껍질 : 원자가 전자(valence electron)